Klinische Bewertung gemäß EU-MDR
Allgemeiner Hintergrund
Die klinische Bewertung ist ein systematischer und geplanter Prozess zur kontinuierlichen Generierung, Sammlung, Analyse und Bewertung der klinischen Daten zu einem Produkt, um die Sicherheit und Leistungsfähigkeit, einschließlich des klinischen Nutzens, des Produkts bei bestimmungsgemäßer Verwendung nachzuweisen. Die klinische Bewertung ist gemäß Artikel 61 und Anhang XIV der europäischen Verordnung über Medizinprodukte 2017/745 (EU-MDR) erforderlich.
Dabei werden die verfügbaren klinischen Nachweise wie klinische Studien, klinische Fachliteratur und präklinische Daten bewertet, um nachzuweisen, dass das Produkt für die vorgesehene Verwendung nach dem allgemein anerkannten Stand der Technik (SOTA) sicher und wirksam ist. Der Bericht über die klinische Bewertung fasst die Ergebnisse des klinischen Bewertungsprozesses zusammen und dient als Nachweis für die Konformität des Produkts mit der EU-MDR. Der Bericht muss während des gesamten Lebenszyklus des Produkts regelmäßig aktualisiert werden, um die kontinuierliche Einhaltung der EU-MDR zu gewährleisten, und ist Teil der Technischen Dokumentation für das Produkt.
Der Prozess der klinischen Bewertung umfasst in der Regel die folgenden Kerndokumente:
- Verfahrensanweisung zur Durchführung der Klinischen Bewertung
- Klinischer Bewertungsplan (CEP)
- Protokoll/Bericht zur Literatursuche zum Stand der Technik und zum Produkt
- Klinischer Bewertungsbericht (CER)
Das Verfahren der klinischen Bewertung beschreibt die relevanten Prozesse und Verantwortlichkeiten, die vom Hersteller festgelegt wurden, um die Erwartungen der EU-MDR und die einschlägigen Leitlinien zum Stand der Technik zu erfüllen.
Zur Durchführung der klinischen Bewertung können folgende Schritte unternommen werden:
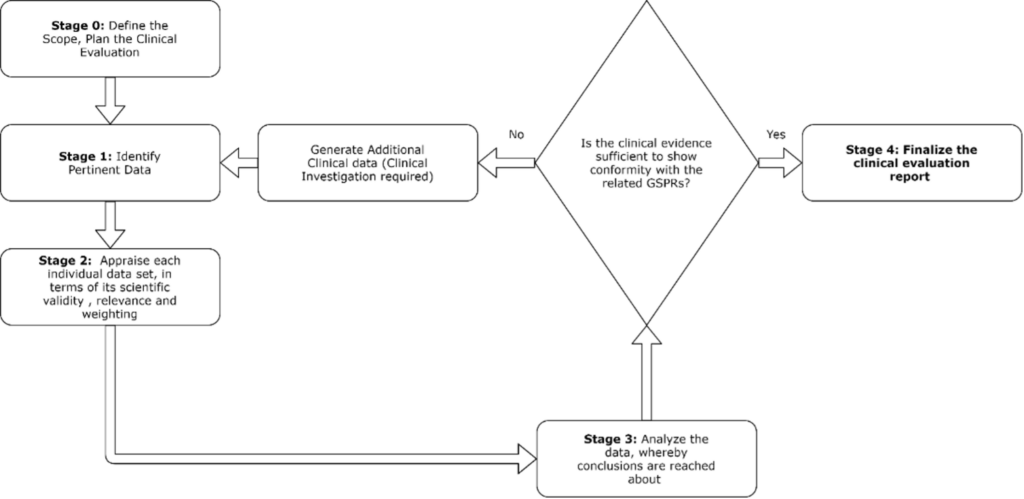
Der klinische Bewertungsplan ist die Grundlage für die Erstellung des klinischen Bewertungsberichts, in dem die zu erwartenden relevanten Dateneingaben und Dokumentationsergebnisse beschrieben werden.
Der klinische Bewertungsplan umfasst Folgendes:
- Relevante Grundlegende Sicherheits- und Leistungsanforderungen (General Safety and Performance Requirements, GSPR), die durch einschlägige klinische Daten unterstützt werden müssen
- Erklärung zur Zweckbestimmung
- Vorgesehene Patientenzielgruppen mit klaren
- Indikationen und Kontraindikationen
- Beabsichtigter klinischer Nutzen für Patienten einschließlich messbarer Sicherheits- und Leistungsparameter
- Methoden zur Bewertung der qualitativen und quantitativen Aspekte der klinischen Sicherheit mit eindeutigem Bezug auf die Bestimmung von Restrisiken und Nebenwirkungen
- Liste der Parameter, anhand derer – auf der Grundlage des Standes der medizinischen Technik – die Annehmbarkeit des Nutzen-Risiko-Verhältnisses für jede Indikation und für alle Zweckbestimmungen des Produkts bestimmt wird
- Beschreibung, wie insbesondere die Abwägung des Nutzen-Risiko-Verhältnisses in Bezug auf bestimmte Komponenten – wie z. B. die Verwendung von pharmazeutischen, nicht lebensfähigen tierischen oder menschlichen Geweben – gelöst wurde.
- Ein klinischer Entwicklungsplan
Die Stufen 0-3 sind im klinischen Bewertungsbericht zusammengefasst und bilden die Grundlage für die Nachweise, mit denen die Einhaltung der einschlägigen GSPR nachgewiesen wird.
Klinische Nachweise werden aus zahlreichen Quellen gespeist. Die für die klinische Bewertung relevanten Daten können entweder im Besitz des Herstellers oder eines Dritten sein. Ferner können Daten für die klinische Bewertung zum in Frage stehenden Produkt oder vergleichbare Produkte aus der wissenschaftlichen Literatur gesammelt werden. Alle relevanten klinischen Daten müssen für das zu bewertende Produkt verfügbar sein.
Die klinischen Daten werden auf der Grundlage der im klinischen Bewertungsplan vorgeschlagenen Strategie ermittelt. Die spezifische klinische Literatur wird anhand des Literaturrechercheprotokolls ermittelt, das die einschlägigen Literaturdatenbanken, die Suchbegriffe sowie die Ein- und Ausschlusskriterien enthält.
Im Analyseabschnitt sollten die Hersteller eine kurze Zusammenfassung der Datenbewertungsmethoden vorlegen. Dies umfasst vor allem auch die Begründung, warum die Daten aus einer bestimmten Studie oder Datenquelle als qualitativ ausreichend und relevant eingestuft werden, um in die klinische Bewertung einbezogen zu werden. Dieser Auswahlprozess umfasst auch die Bewertung des Studiendesigns, von systematischen Fehlern und Störgrößen, Peer-Reviews und Relevanz der Daten im Hinblick auf das in Frage stehende Produkt.
Relevante Datensätze sollten auf der Grundlage der wissenschaftlichen Qualität und der Relevanz für den Umfang und die Ziele der klinischen Bewertung der betreffenden Produkte gewichtet werden. Die Akzeptanz der Bewertung sollte sich an folgenden Kriterien orientieren:
- Methodische Qualität und wissenschaftliche Validität der gefundenen und als geeignet bewerteten Artikel
- Relevanz der Informationen für die klinische Bewertung, wie sie bewertet und dokumentiert wurden
- Beitrag der einzelnen Datensätze zur klinischen Bewertung, gewichtet nach systematischen Kriterien
Das Ziel der Analysephase ist es, im klinischen Bewertungsbericht Schlussfolgerungen zu ziehen, ob die klinischen Daten geeignet und ausreichend sind, um die produktrelevanten grundlegenden Sicherheits- und Leistungsanforderungen (GSPR) zu erfüllen. Darüber hinaus werden klinische Aussagen durch verfügbare Evidenzen untermauert und die Bewertung des Nutzen-Risiko-Verhältnisses dargestellt.
Die Schlussfolgerungen umfassen Informationen, ob die für das betreffende Produkt verfügbaren geprüften Datensätze ausreichen, um insgesamt die Sicherheit, klinische Leistungsfähigkeit und/oder Wirksamkeit des Produkts in Bezug auf seine Zweckbestimmung nachzuweisen.
Die Schlussfolgerungen zum Nutzen-Risiko-Verhältnis sollten umfassen:
- Zusammenfassung des klinischen Nutzens in Bezug auf das sinnvolle und messbare patientenrelevante klinische Ergebnis. Ihre positiven Auswirkungen auf das Patientenmanagement oder die öffentliche Gesundheit.
- Risiken mit klinischer Relevanz (z. B. Unsicherheiten oder Einschränkungen der klinischen Daten, unerwünschte Nebenwirkungen, Fehlanwendungspotenzial usw.) und kurze Beschreibung (z. B. Häufigkeit, Schweregrad, Dauer, gefährdete Patientenuntergruppen, gegebenenfalls Dosis-Wirkungs-Beziehung usw.).
- Auswirkungen der Risiken im Verhältnis zum klinischen Nutzen unter Berücksichtigung der beschriebenen Faktoren und insbesondere der Unsicherheiten in Bezug auf die verfügbaren klinischen Daten.
Je nach zu bewertendem Produkt und klinischer Strategie ist der klinische Bewertungsbericht entsprechend zu strukturieren. Im Allgemeinen umfasst der klinische Bewertungsbericht die folgenden Abschnitte:
- Zusammenfassung
- Umfang
- Stand der Technik
- Nachweise für das zu bewertende Produkt.
- Präklinische Daten.
- Überprüfung der klinischen Literatur.
- Klinische Untersuchungsdaten.
- Daten zur Überwachung nach dem Inverkehrbringen und zur klinischen Nachbeobachtung nach dem Inverkehrbringen.
- Datenbegutachtung
- Datenanalyse
- Schlussfolgerungen
Der klinische Bewertungsbericht muss von einer Person oder einem Team bewertet werden, die/das über Qualifikationen (einschlägiger Hochschulabschluss und 5 Jahre Erfahrung oder 10 Jahre Erfahrung) in den folgenden Bereichen verfügt:
- Forschungsmethodik
- Informationsmanagement
- Regulatorische Anforderungen
- Verfassen medizinischer Texte
- Produkttechnik und ihre Anwendung
- Diagnose und Behandlung der Erkrankungen, die durch das Produkt diagnostiziert oder behandelt werden sollen
- Kenntnisse über medizinische Alternativen, Behandlungsstandards und Technologien (klinischer Hintergrund)
Der klinische Bewertungsbericht muss in regelmäßigen Abständen überprüft und aktualisiert werden, um sicherzustellen, dass er auf dem neuesten Stand ist und alle neuen Informationen oder Daten berücksichtigt sind. Die Häufigkeit der Überprüfung bzw. Aktualisierung ist abhängig von folgenden Faktoren:
- Risikopotential des Produkts (gering/ erheblich?)
- Ist das Produkt gut etabliert, wobei Folgendes zu berücksichtigen ist:
- Innovation
- Relevante Änderungen in den klinischen Wissenschaften, den Werkstoffwissenschaften oder anderen Wissenschaften im Zusammenhang mit dem zu bewertenden Produkt
- Der derzeitige Vertrauensgrad in die aktuelle Bewertung der klinischen Leistungsfähigkeit und der klinischen Sicherheit des Produkts
- Gesamtzahl der bisher auf dem Markt verwendeten Produkte und erwartete Melderaten im Rahmen des Vigilanzsystems
- Mittel- oder langfristige Risiken, Ungewissheiten und/oder unbeantwortete Fragen, die die Häufigkeit der Aktualisierungen möglicherweise beeinflussen
- Designänderungen oder Änderungen der Herstellungsverfahren
Support & Training
Wenden Sie sich an AKRA TEAM, wenn Sie Unterstützung, praktische Umsetzung und personalisierte Schulungen von Experten mit Schlüsselkompetenzen in den unten aufgeführten Bereichen benötigen.
Kernpunkte
Der Stand der Technik (SOTA) wird bei der Überprüfung durch die benannte Stelle sehr genau begutachtet. Es wird erwartet, dass eine gründliche Recherche über den klinischen Hintergrund, die medizinischen Rahmenbedingungen, Leitlinien/Standards, die aktuelle medizinische Praxis, alternative Therapien, ähnliche Produkte, Benchmark-Produkte, SOTA-Nutzen-Risiko-Analysen und Benchmarks für Sicherheit und Leistungsfähigkeit durchgeführt und dokumentiert wurde.
Die klinischen Aussagen zu dem betreffenden Produkt müssen im klinischen Bewertungsbericht spezifiziert und mit ausreichenden klinischen Daten belegt werden.
Für jedes Produkt muss der klinische Nutzen definiert und mit geeigneten messbaren Leistungsergebnissen unterlegt werden. Der klinische Nutzen muss der Zweckbestimmung des Produkts entsprechen.
Die Sicherheits- und Leistungsergebnisse sollten quantitativ und patientenrelevant sein und auf der Grundlage von Benchmark-Werten ermittelt werden, die sich aus der Literaturrecherche zum Stand der Technik ergeben.
Die Wahl der richtigen klinischen Strategie ist der Schlüssel zur EU-MDR. Qualität und Quantität der erforderlichen klinischen Nachweisdaten hängen wesentlich davon ab, ob das Produkt Äquivalenz beanspruchen kann, ob es sich um eine etablierte Technologie handelt, und inwieweit klinische Daten als nicht erforderlich (Artikel 61 Absatz 10) oder ausreichend erachtet werden. In jedem Fall gibt das in Frage stehende Medizinprodukt die Qualität und Quantität der erforderlichen klinischen Nachweise vor.
Unsere Leistungen
Schulungen
AKRA TEAM bietet Schulungen zur klinischen Bewertung und zum Verfassen von klinischen Bewertungsberichten sowie zu individuellen Themen wie SOTA, Entwicklung von produktspezifischen Sicherheits- und Leistungsparametern, die klinische Strategie und mehr an.
Entwicklung von Verfahrensanweisungen und Dokumentvorlagen
Für alle Aspekte der klinischen Bewertung stehen bewährte Vorlagen für Verfahrensanweisungen und Dokumentvorlagen zur Verfügung:
- Verfahrensanweisung zur Klinischen Bewertung
- Klinischer Bewertungsplan
- Klinischer Bewertungsbericht
- Protokoll/Bericht zur Literatursuche
- Strukturelles Vorgehen zur Ermittlung des Stands der Technik (SOTA)
Gap-Analysen
AKRA TEAM bietet umfassende Gap-Analysen zur klinischen Dokumentation an. In diesen Analysen werden Risiken identifiziert und Verbesserungsvorschläge erarbeitet. Im Rahmen der Gap-Analyse werden zunächst potenzielle Risiken für die Einreichung identifiziert (von gering bis hoch). Im folgenden Schritt schlägt AKRA TEAM Ihnen Maßnahmen zur Risikominderung und Optimierung der Dokumente vor. So können Sie Korrekturen vornehmen, bevor Sie die Dokumente zur Prüfung durch die benannte Stelle einreichen.
Umsetzung
AKRA TEAM verfügt über ein erfahrenes Team von medizinischen Redakteuren, Klinikern und Experten aus dem regulatorischen Umfeld, die klinische Bewertungen und die dazugehörige Dokumentation für alle Produktkategorien und Risikoklassen erstellen. Wir bieten maßgeschneiderte und umfassende Lösungen für die Bedürfnisse eines jeden Herstellers an. Wenn sich Ihre klinische Bewertung aktuell in der Begutachtungsphase befindet, können wir außerdem gezielt Aktualisierungs- und Verbesserungsvorschläge auf der Basis der festgestellten Mängel im Bericht der benannten Stelle anbieten.
Kontinuierliche Aktualisierung der Dokumentation
AKRA TEAM bietet zusätzlich Lösungen für die kontinuierliche Aktualisierung der Dokumentation an. Akra Team plant und überarbeitet die Dokumentation in festgelegten Abständen, um sicherzustellen, dass die Einhaltung der Vorschriften gemäß den Erwartungen der EU-MDR gewährleistet ist.