Erstellung des Kurzberichts über Sicherheit und klinische Leistung (Summary of Safety and Clinical Performance, SSCP)
Fallstricke und Lösungen
Allgemeiner Hintergrund
Die EU-MDR beinhaltet gegenüber der MDD einige Neuerungen und Pflichten, die Hersteller erfüllen müssen. Unter anderem ist der Kurzbericht über die Sicherheit und klinische Leistung (SSCP) ein wichtiges Dokument, das von den Herstellern für implantierbare Medizinprodukte und Medizinprodukte der Klasse III gemäß Artikel 32 EU-MDR erstellt werden muss. Die Leitlinie MDCG 2019-9 Rev. 1 enthält Einzelheiten zum Inhalt, zum Verfahren der Erstellung und zum Hochladen der SSCPs in EUDAMED, einschließlich einer Vorlage.
Der SSCP ist ein öffentlich zugängliches Dokument, das in EUDAMED gespeichert wird, sobald die Datenbank voll funktionsfähig ist. Der Name des Dokuments weist bereits auf seinen Inhalt hin, der folgend skizziert ist.
Zu den wichtigsten Schritten der klinischen Nachbeobachtung nach dem Inverkehrbringen im Rahmen der EU-MDR gehören:
Abschnitte des Kurzberichts über Sicherheit und klinische Leistung (SSCP)
- Die Kennzeichnung des Produkts und des Herstellers, einschließlich der Basis UDI-DI und, falls bereits vergeben, die SRN
- Die Zweckbestimmung des Produkts sowie alle Indikationen, Kontraindikationen und Zielgruppen
- Eine Beschreibung des Produkts, einschließlich eines Verweises auf frühere Generationen oder Varianten, falls vorhanden, und eine Beschreibung der Unterschiede sowie gegebenenfalls eine Beschreibung von Zubehör und anderen Produkten, die zur Verwendung in Kombination mit dem Produkt vorgesehen sind
- Informationen über alle Restrisiken und Nebenwirkungen, Warnhinweise und Vorsichtsmaßnahmen
- Die Zusammenfassung der klinischen Bewertung gemäß Anhang XIV und relevante Informationen über die klinische Nachbeobachtung nach dem Inverkehrbringen
- Mögliche diagnostische oder therapeutische Alternativen
- Vorgeschlagenes Profil und Schulung für Benutzer
- Verweis auf alle harmonisierten Normen und angewandte Gemeinsame Spezifikationen
- Änderungsshistorie
Kombiniert man die oben genannten Informationen über den erforderlichen Inhalt und die beabsichtigte(n) Zielgruppe(n), werden die spezifischen Zweckbestimmungen eines SSCP deutlich (unten, linke Seite). Ein SSCP ist nicht als Ersatz für andere Dokumente oder gar als eine professionelle Gesundheitsberatung anzusehen, wie unten (rechte Seite) dargestellt.
Was ist der Zweck des Kurzberichts über Sicherheit und klinische Leistung (SSCP) für Medizinprodukte?
Ziel
Der SSCP soll …
- Einen öffentlichen Zugang für die Zielgruppen mit aktuellen/aktualisierten Informationen über das Produkt bieten
- Zweckbestimmung, Funktion usw.
- Sicherheitsaspekte des Produkts FSCA, FSN
- FSCA, FSN
- Klinische Leistung des Produkts
- Klinischer Nutzen für Patienten
- Folgende (Nutzer-)Gruppen ansprechen
- Angehörige von Heilberufen
- Patienten als indirekte Endnutzer oder direkte Nutzer (falls zutreffend)
- Letztendlich für mehr Transparenz und einen leichten Zugang zu Informationen sorgen
Nicht das Ziel
Der SSCP soll nicht …
- Allgemeine Ratschläge zur Diagnose oder Behandlung (Therapievorschläge) zu bestimmen Krankheitsbildern für Nutzer oder Patienten erteilen, noch
- die Gebrauchsanweisung als wichtigstes Dokument zur Gewährleistung der sicheren Verwendung eines Produkts ersetzen, noch
- die obligatorischen Angaben in Implantatausweisen oder anderen obligatorischen Dokumenten ersetzen, noch
- die ggf. notwendige Beratung durch Angehörige der Heilberufe ersetzen, noch
- als Marketing- oder Verkaufsprospekt verwendet/verstanden werden!
Besondere Aspekte eines SSCP
Da der SSCP ein integraler Bestandteil des Konformitätsbewertungsprozesses ist, empfiehlt es sich, die Anforderungen vor der Erstellung des Dokuments näher zu betrachten.
Die folgenden wichtigen Aspekte sollten berücksichtigt werden:
- Der SSCP ist integraler Bestandteil der Technischen Dokumentation (TD).
- Der SSCP muss von der benannten Stelle validiert werden, die für die Erstzertifizierung und alle Aktualisierungen zuständig ist.
- Die Zielgruppe des SSCP sind Angehörige von Heilberufen und/oder – in bestimmten Fällen – Patienten.
- Neben dem Inhalt gibt es eine Reihe stilistischer Anforderungen für die Erstellung konformer SSCPs, insbesondere für den Teil, der sich an Patienten richtet.
- Der SSCP muss stets auf dem neuesten Stand gehalten werden.
„Füttern“ des SSCP mit Inhalten
Für die Erstellung eines SSCP ist es nicht erforderlich, neue Daten zu sammeln oder zu generieren. Der SSCP sollte vollständig aus den unten dargestellten Teilen der Technischen Dokumentation erstellt werden. Daraus ergibt sich, dass alle Ausgangsdokumente in einem guten Zustand sein sollten, bevor der SSCP erstellt wird. Es macht keinen Sinn, mit der Ausarbeitung eines SSCP zu beginnen, bevor der klinische Bewertungsbericht (CER), die Gebrauchsanweisung (IFU) und andere Dokumente der Technischen Dokumentation fertiggestellt sind.
Der SSCP ist das Ende der Nahrungskette …
Der SSCP sollte gemäß Anhang II und Anhang III der EU-MDR vollständig aus der Technischen Dokumentation gespeist werden.
Die Quelldokumente umfassen hauptsächlich:
- Klinischer Bewertungsbericht (CER)
- Gebrauchsanweisung (IFU)
- Risikomanagementdokumentation (RM)
- Dokumentation der Überwachung und klinischen Nachbeobachtung nach dem Inverkehrbringen (PMS/PMCF)
- Andere objektive Nachweise aus der Technischen Dokumentation (z. B. Designverifizierungs-/Validierungsberichte, die beispielsweise Informationen über frühere Generationen/Unterschiede, Gründe für Änderungen etc. enthalten)
Wenn der SSCP nicht ohne weiteres aus diesen Dokumenten gespeist werden kann, ist davon auszugehen, dass der klinische Bewertungsbericht (CER) oder andere Dokumente nicht in einem guten Zustand sind!
Überarbeiten Sie diese Dokumente – vor der Fertigstellung des SSCP.
Wann muss ein SSCP für Patienten erstellt werden?
Ein SSCP für Patienten ist erforderlich für (a) implantierbare Produkte, für die Patienten einen Implantatausweis erhalten, und (b) Produkte der Klasse III, die zur direkten Anwendung durch die Patienten bestimmt sind (Hinweis: Für Produkte, die in Anhang XVI der EU-MDR aufgeführt sind und für einen SSCP in Frage kommen, sollten immer als relevant für die Erstellung eines SSCP angesehen werden).
Stilistische und sprachliche Anforderungen
Um sicherzustellen, dass der Teil des SSCP, der den Patienten betrifft, auch von Laien verstanden wird, verlangt die MDCG-Leitlinie die Verwendung von Laiensprache. Um die Lesbarkeit des Inhalts – oder besser die Verständlichkeit – zu überprüfen, empfiehlt sich eine Kombination aus Lesbarkeitstests (z. B. ein Flesch-Reading-Ease-Score) und Anwendungsprüfungen, die mit einer repräsentativen Zielgruppe durchgeführt werden. Von den benannten Stellen wird es häufig als Nichtkonformität beanstandet, wenn die für den Patiententeil verwendete Sprache für Laien nicht verständlich ist.
Im erforderlichen Validierungsschritt wird die Bewertung eines SSCP-Entwurfs von der benannten Stelle in einer vorher definierten Sprache durchgeführt. Die Übersetzung in alle anderen Sprachen liegt in der Verantwortung des Herstellers. Weitere Empfehlungen sind unten dargestellt.
Anforderungen an einen SSCP / Erwartungen der benannten Stelle?
- Technisch: Druckbares / durchsuchbares Format (PDF)
- Layout: Schriftart und -größe sollten ein leichtes Lesen ermöglichen, Dokument sollte gut strukturiert/gegliedert sein (z. B. durch Überschriften, Absätze)
- Inhalt: Leicht lesbar, prägnant, unmissverständlich und klar, objektiv, angemessene Darstellung von sowohl positiven als auch negativen Daten
- Sprache: Verständlich für Patienten und Laien (für den Patiententeil)
- Der SSCP ist nicht als Marketing- oder Verkaufsprospekt gedacht. Siehe MDCG 2020-19 Rev. 1.

Der SSCP als Teil der Technischen Dokumentation
Der SSCP steht in engem Zusammenhang mit einer Reihe anderer Dokumente der Technischen Dokumentation, wie unten dargestellt. Es ist von größter Bedeutung, dass der Inhalt des SSCP mit den entsprechenden Dokumenten der Technischen Dokumentation übereinstimmt.
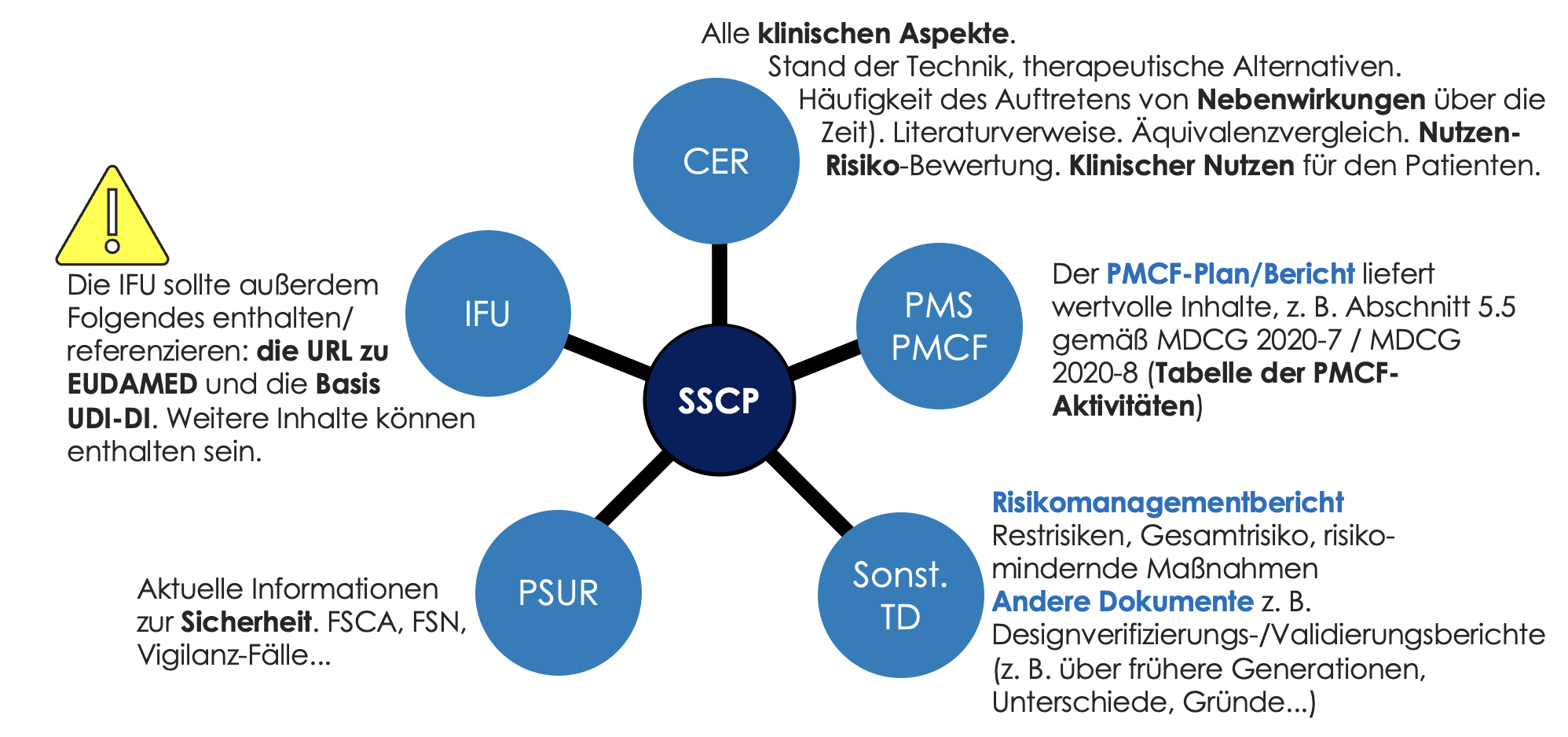
Die drei wichtigsten Buchstaben des Kürzels SSCP sind S für „Safety“ und CP für „Clinical Performance“ (klinische Leistung). Der SSCP steht somit in engem Zusammenhang mit der Risikomanagementakte (Risk Management File, RMF), dem klinischen Bewertungsbericht (Clinical Evaluation Report, CER), der klinischen Nachbeobachtung nach dem Inverkehrbringen (Post Market Clinical Follow-Up, PMCF) und dem regelmäßig aktualisierten Bericht zur Sicherheit (Periodic Safety Update Report, PSUR).
Wann immer eines dieser Dokumente während der Lebensdauer des Produkts aktualisiert wird, muss der SSCP entsprechend angepasst werden. Hinweis: Je nach Risikoklasse des Produkts muss bei Aktualisierungen möglicherweise die benannte Stelle eingeschaltet werden. Der SSCP ist mindestens mit den jährlichen Aktualisierungen des PSUR bzw. PMCF-Report zu aktualisieren (falls erforderlich).
Fallstricke und Lösungen
Obwohl die Leitlinie MDCG 2019-9 Rev. 1 eine Vorlage und eine ausführliche Beschreibung der Anforderungen enthält, sind bestimmte Abschnitte für Feststellungen durch die benannte Stelle anfällig. Dabei handelt es sich insbesondere um Abschnitt 4 (Risiken und Warnhinweise > Quantifizierungen und zeitlicher Bezug) und Abschnitt 5 (Zusammenfassung der klinischen Bewertung und klinische Nachbeobachtung nach dem Inverkehrbringen > Zusammenfassung der klinischen Leistung und Sicherheit im Vergleich zum Stand der Technik). Für eine erfolgreiche Überprüfung durch die benannte Stelle ist es wichtig, die Anweisungen des Leitfadens MDCG 2019-9 Rev. 1 sorgfältig zu befolgen.
AKRA TEAM unterstützt Sie gerne bei allen Fragen rund um den SSCP!
Support & Training
Wenden Sie sich an AKRA TEAM, wenn Sie Unterstützung, praktische Umsetzung und personalisierte Schulungen von Experten mit Schlüsselkompetenzen in den unten aufgeführten Bereichen benötigen.
Kernpunkte
Der SSCP ist ein wichtiges Dokument im Konformitätsbewertungsverfahren. Obwohl ein MDCG-Leitfaden für die Erstellung von SSCPs zur Verfügung steht, scheint die Beschreibung in MDCG 2019-9 Rev. 1 in einigen Bereichen nicht eindeutig zu sein, was zu unterschiedlichen Auslegungen durch Hersteller und somit zu unterschiedlichen Ergebnissen führt. Dies wiederum kann die Bewertung durch die benannten Stellen erschweren oder sogar zur Ablehnung führen.
Um es auf den Punkt zu bringen: Bei der Erstellung von SSCPs ist es wichtig, sorgfältig vorzugehen und vor allem die Punkte zu berücksichtigen, die im Folgenden zusammengefasst sind.
SSCP: Was ist zu tun, um die Rechtsvorschriften einzuhalten?
Das Dokument MDCG 2019-9 Rev. 1 enthält Informationen über den erforderlichen Inhalt sowie zwei (!) Vorlagen.
WICHTIGER HINWEIS
Es gibt verschiedene Vorlagen für Angehörige der Heilberufe und für Patienten. Prüfen Sie sorgfältig, ob das Medizinprodukt direkt vom Patienten verwendet werden soll und ob ein Implantatausweis für das Produkt benötigt wird. In beiden Fällen ist ein Patiententeil obligatorisch. MDCG 2019-9 Rev. 1 empfiehlt Standardtexte für Angehörige der Heilberufe und Patienten am Beginn des Dokuments. Nehmen Sie diese Passagen in den SSCP auf.
Stellen Sie sicher, dass:
die Quelldokumente in einem gutem Zustand sind.
Sie der in den Vorlagen vorgeschlagenen Nummerierung und Struktur (siehe MDCG 2019-9 Rev. 1) folgen.
die Ausgabedateien durchsuchbar und druckbar sind (PDF).
in der Gebrauchsanweisung auf den SSCP verwiesen wird.
für Patienten „Laiensprache“ verwendet wird und medizinische Fachtermini vermieden werden.
alle Abkürzungen erklärt werden bzw. eine Liste der Abkürzungen vorangestellt wird.
der Inhalt mit dem klinischen Bewertungsbericht und der Gebrauchsanweisung abgeglichen ist.
auf Elemente mit Werbecharakter verzichtet wurde.
der Inhalt in organisierter und unmissverständlicher Weise präsentiert wird.
EMDN-Codes für die Produkte verwendet wurden.
Unsere Leistungen
Beratung vor der Ausarbeitung eines SSCP-Dokuments durch unsere Experten.
Gap-Analyse /Vorprüfung von SSCP-Entwürfen inklusive detaillierter Empfehlungen für Verbesserungen.
Beratung zu Nichtkonformitäten/Mängeln, die von der benannten Stelle identifiziert wurden. Unterstützung bei Antwortschreiben an die benannte Stelle.
EU-MDR-konforme SSCP-Vorlage mit umfassenden Beschreibungen. Dies wird Ihnen bei der Erstellung des SSCP und der Berücksichtigung der unterschiedlichen Anforderungen helfen.
Implementierung des SSCP-Prozesses als Teil des Zertifizierungsprozesses.
Webinar/Schulung zur Erstellung von SSCPs (Grundlagen / Fallstricke & Lösungen / Empfehlungen).